PR
Your promising partner CellabMED
보도자료
셀랩메드 CAR-T 치료제 1상 돌입
No. 24
2022-01-04
12월 바이오 '임상 3상 14건'…셀트리온 악템라 시밀러 1상 승인
국내 5건 앱클론·셀랩메드 CAR-T 치료제 1상 돌입…메디톡스·휴온스바이오파마 보톡스 임상
항암·항종양 타깃 34건 중 21건 61.8%…폐암치료제 임상 활발 3상 4건·2상 2건 승인
항암·항종양 타깃 34건 중 21건 61.8%…폐암치료제 임상 활발 3상 4건·2상 2건 승인
입력 2022.01.04 06:00 수정 2022.01.04 10:55
약업닷컴(약업신문)이 식품의약품안전처 의약품통합정보시스템 임상시험정보 자료를 분석한 결과, 2021년 12월 한 달간(1일~31일) 바이오의약품의 임상시험계획(IND) 승인이 34건 이뤄진 것으로 나타났다.
임상시험 승인 현황으로는 ▲임상 3상 14건 ▲임상 2상 7건 ▲임상 1상 10건 ▲연장 3건으로 확인됐다.
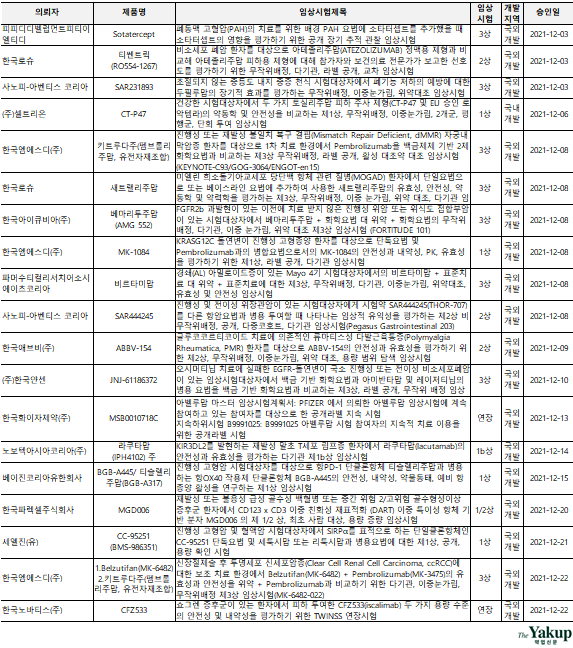
`임상 3상`을 승인받은 기업은 ▲피피디디벨럽먼트피티이엘티디(PPD, CRO) ▲사노피-아벤티스 코리아(Sanofi-Aventis) ▲한국엠에스디(MSD) ▲한국로슈(Roche) ▲한국아이큐비아(IQVIA, CRO) ▲파머수티컬리서치어소시에이츠코리아(CRO) ▲한국얀센(Janssen) ▲베이진코리아(CRO) ▲아이엔씨리서치사우쓰코리아(CRO) ▲한국아스트라제네카(AstraZeneca)로 나타났다.
이 중 한국로슈는 3건, 한국엠에스디는 2건, 한국아이큐비아는 2건의 임상 3상을 승인받은 것으로 나타났다.
`임상 2상`을 승인받은 기업은 ▲한국로슈 ▲사노피-아벤티스 코리아 ▲한국애브비(AbbVie) ▲아이엔씨리서치사우쓰코리아(CRO) ▲에이디엠코리아(ADM Korea, CRO) ▲휴온스바이오파마로 집계됐으며, 이 중 한국로슈가 2건의 임상 2상을 승인받았다.
`국내 개발`은 5건으로 ▲셀트리온(1상) ▲메디톡스코리아(연장) ▲셀랩메드(1상) ▲앱클론(1/2상) ▲휴온스바이오파마(2상)가 임상시험을 승인받은 것으로 나타났다.
`항암 및 항종양`을 타깃하는 임상시험은 21건으로 총 34건 중 61.8%를 차지하는 것으로 분석됐다. 이중 ▲3상 8건 ▲2상 4건 ▲1상 6건 ▲연장 1건으로 나타났다.
아울러 지난해 11월 항암 및 항종양을 타깃하는 임상시험은 11건으로 39.3%를 차지했고, 10월에는 12건으로 54.5%, 9월에는 20건으로 64.5%, 8월에는 16건으로 59.25%로 집계돼 바이오의약품 임상시험의 상당 부분이 항암을 대상으로 진행되는 것으로 분석됐다.
특히 지난해 12월에는 비소세포성 폐암을 타깃으로 5건, 소세포성 폐암을 타깃으로 1건이 승인돼, 최근 활발한 폐암 치료제 개발 현황을 나타냈다. 또한 한국로슈에서는 티쎈트릭(Tecentriq)을 사용해, 두 폐암을 대상으로 동시에 임상시험을 승인받았다. 아울러 폐암 치료를 타깃으로 3상에 4건, 2상에 2건이 승인된 것으로 나타났다.
메디톡스와 휴온스바이오파마에서는 보톡스에 대한 `중등증 및 중증의 미간 주름 개선` 임상 연장 및 임상 2상 시험을 승인받은 것으로 나타났다.
이외 ▲폐동맥 고혈압(PAH) ▲천식 ▲아밀로이드증 ▲류마티스성 다발근육통증(PMR) ▲쇼그렌증후군 ▲결절성 양진 ▲근위축측삭경화증(fALS) 및 산발형 근위축측삭경화증(sALS) ▲B세포성림프종 ▲A형 혈우병 등에 대한 적응증 및 병용요법 임상시험이 승인된 것으로 분석됐다.
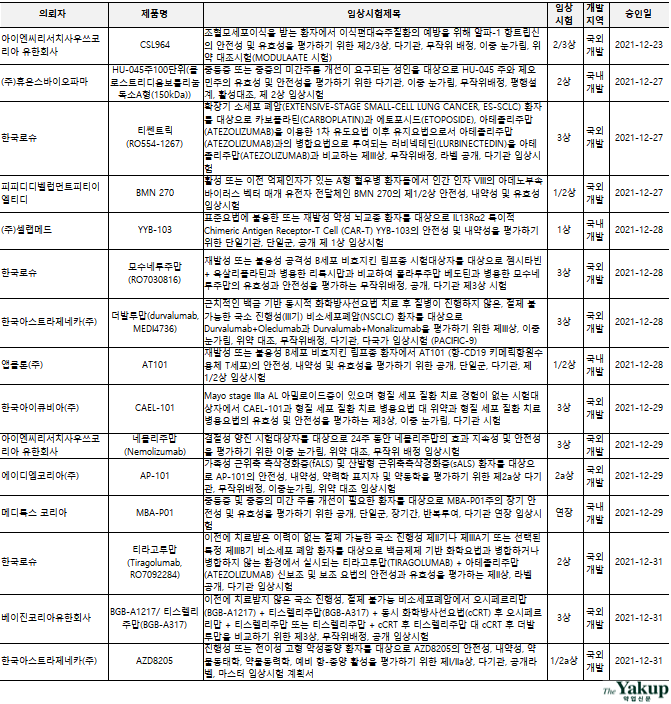
이 중 한국로슈는 3건, 한국엠에스디는 2건, 한국아이큐비아는 2건의 임상 3상을 승인받은 것으로 나타났다.
`임상 2상`을 승인받은 기업은 ▲한국로슈 ▲사노피-아벤티스 코리아 ▲한국애브비(AbbVie) ▲아이엔씨리서치사우쓰코리아(CRO) ▲에이디엠코리아(ADM Korea, CRO) ▲휴온스바이오파마로 집계됐으며, 이 중 한국로슈가 2건의 임상 2상을 승인받았다.
`국내 개발`은 5건으로 ▲셀트리온(1상) ▲메디톡스코리아(연장) ▲셀랩메드(1상) ▲앱클론(1/2상) ▲휴온스바이오파마(2상)가 임상시험을 승인받은 것으로 나타났다.
`항암 및 항종양`을 타깃하는 임상시험은 21건으로 총 34건 중 61.8%를 차지하는 것으로 분석됐다. 이중 ▲3상 8건 ▲2상 4건 ▲1상 6건 ▲연장 1건으로 나타났다.
아울러 지난해 11월 항암 및 항종양을 타깃하는 임상시험은 11건으로 39.3%를 차지했고, 10월에는 12건으로 54.5%, 9월에는 20건으로 64.5%, 8월에는 16건으로 59.25%로 집계돼 바이오의약품 임상시험의 상당 부분이 항암을 대상으로 진행되는 것으로 분석됐다.
특히 지난해 12월에는 비소세포성 폐암을 타깃으로 5건, 소세포성 폐암을 타깃으로 1건이 승인돼, 최근 활발한 폐암 치료제 개발 현황을 나타냈다. 또한 한국로슈에서는 티쎈트릭(Tecentriq)을 사용해, 두 폐암을 대상으로 동시에 임상시험을 승인받았다. 아울러 폐암 치료를 타깃으로 3상에 4건, 2상에 2건이 승인된 것으로 나타났다.
메디톡스와 휴온스바이오파마에서는 보톡스에 대한 `중등증 및 중증의 미간 주름 개선` 임상 연장 및 임상 2상 시험을 승인받은 것으로 나타났다.
이외 ▲폐동맥 고혈압(PAH) ▲천식 ▲아밀로이드증 ▲류마티스성 다발근육통증(PMR) ▲쇼그렌증후군 ▲결절성 양진 ▲근위축측삭경화증(fALS) 및 산발형 근위축측삭경화증(sALS) ▲B세포성림프종 ▲A형 혈우병 등에 대한 적응증 및 병용요법 임상시험이 승인된 것으로 분석됐다.
국내 기업 현황을 살펴보면, `셀트리온`이 `건강한 시험대상자에서 두 가지 토실리주맙 피하 주사 제형(CT-P47 및 EU 승인 로악템라)의 약동학 및 안전성 비교`에 대한 임상시험 1상을 지난해 12월 6일 승인받았다.
셀트리온의 `CT-P47`은 로슈의 악템라(토실리주맙) 바이오시밀러 제품으로 류머티스 관절염 치료제다. 피하 및 정맥 주사 제형 중 셀트리온은 피하주사 제형으로 개발할 예정이다. 아울러 악템라는 지난해 6월 미국 FDA와 유럽 EMA로부터 코로나19 치료제로 긴급사용승인 및 중증 사용 승인을 받은 바 있다.
셀랩메드는 `표준요법에 불응한 또는 재발성 악성 뇌교종 환자를 대상으로 IL13Rα2 특이적 Chimeric Antigen Receptor-T Cell (CAR-T) YYB-103의 안전성 및 내약성 평가`에 대한 임상시험 1상을 지난해 12월 28일 승인받았다.
셀랩메드는 항체신약과 CAR-T 기반의 바이오혁신신약을 연구·개발하는 기업으로 지난해 11월 시리즈B를 통해 230억원 규모의 투자를 유치했으며, 창립 후 총 338억원 규모의 투자를 유치해 우수한 기술력을 입증받았다.
셀랩메드의 `YYB-103`은 교모세포종 치료제로 해당 특이 항원만 인식하는 Ligand(수용체 결합 물질)를 사용해 종양 선택성과 항암 효과가 극대화된 것으로 평가되고 있다. 또 고형암을 타깃으로 한 차별성과 다른 고형암으로의 적응증 확장 가능성이 큰 것으로 알려져 있다.
앱클론은 `재발성 또는 불응성 B세포 비호지킨 림프종 환자에서 AT101(항-CD19 키메릭항원수용체 T세포)의 안전성, 내약성 및 유효성 평가`에 대한 임상시험 1/2상을 지난해 12월 28일 승인받았다.
앱클론의 `AT101`은 질환 단백질 CD19을 표적하는 CAR-T 면역항암 세포치료제로, 기존 혈액암 타깃 CAR-T 세포치료제들과 적용 부위(에피토프)가 전혀 다른 특징을 가지고 있다. 또한 앱클론은 자체 항체 발굴 플랫폼 NEST(Novel Epitope Screening Technology)를 통해 새로운 에피토프에 최적화된 ‘1218 항체’를 개발하고 이를 AT101에 적용했다고 설명했다.
아울러 앱클론은 AT101의 전임상시험을 통해 킴리아 불응 및 재발 모델의 암세포 사멸 효과를 확인했다고 밝힌 바 있어, 이번 임상에서도 유의미한 결과를 도출할 수 있을 것으로 기대를 모으고 있다.
 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기